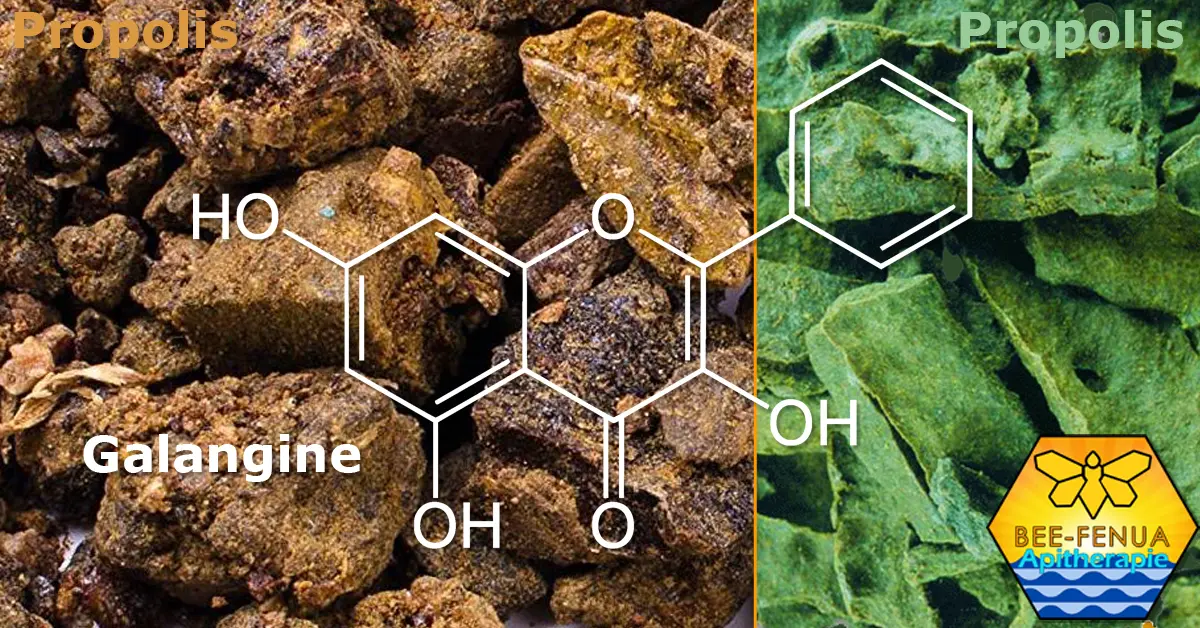
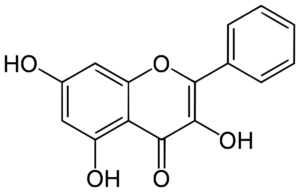
La Galangine un flavonol de la propolis brune
La galangine est un polyphénols abondant dans la propolis brune.
Elle est aussi présente dans la propolis verte.
Quelles sont les propriétés de la Galangine ?
- Antiartrite,
- Antineurodégéneratif,
- Antitumoral,
- Antidiabétique,
- Antiasthmatique,
- Cardiovasculaire,
- Hépato protectrice.
Exploration du potentiel de la galangine en tant qu’agent analgésique et anti-inflammatoire, en particulier dans le contexte de la douleur inflammatoire.
La galangine possède des effets anti-inflammatoires, protecteurs pour différents organes, antidiabétiques et anticancéreux.
Effet analgésique de la galangine : La galangine a augmenté la latence à la stimulation thermique chez les souris, ce qui suggère une capacité à inhiber l’analgésie centrale.
Effet inhibant la sensibilité à la douleur de la galangine : La galangine a diminué le nombre de contorsions chez les souris soumises au test de contorsions abdominales induites par l’acide acétique, indiquant un effet antinociceptif dépendant de la dose.
Effet anti-inflammatoire de la galangine : La galangine a inhibé l’augmentation de la perméabilité capillaire péritonéale induite par l’acide acétique chez les souris, ce qui met en évidence sa capacité à atténuer l’inflammation aiguë et la douleur.
La galangine a réduit de manière significative la durée du léchage du stress au cours des phases I et II du test de la formaline chez la souris, ce qui démontre sa capacité à inhiber à la fois la douleur neurogène précoce et la douleur inflammatoire.
La galangine a entraîné une réduction significative du volume de l’œdème de la patte chez les souris soumises au test d’œdème de la patte au carraghénane, ce qui indique des effets anti-inflammatoires.
La galangine a supprimé la production et les niveaux de médiateurs pro-inflammatoires, notamment l’IL-1β, l’IL-6, le TNF-α, la PGE2, le CGRP et la SP, ainsi que l’activité de la COX-2 chez les rats souffrant de douleur inflammatoire induite par la capsaïcine.
A des concentrations élevées (500, 1000 et 2000 mg/kg), la galangine n’a aucun impact sur le poids corporel ni sur la mortalité des rats mâles et femelles, et ne provoque pas d’inflammation.
La galangine pourrait avoir le potentiel de servir d’agent thérapeutique en ciblant la modulation de la TRPV1 pour la douleur inflammatoire.
Cependant, des recherches supplémentaires sont nécessaires pour explorer le rôle thérapeutique et les mécanismes de la galangine dans d’autres types de douleur.
La galangine et les cellules cancéreuses du sein
Il a été démontré que la galangine favorise l’autophagie et déclenche la mort cellulaire programmée dans les cellules cancéreuses.
Des expériences en 2023 avec des nanoparticules d’or (AuNPs) chargées de galangine (GAL) se sont révélées très efficaces pour inhiber la croissance et la migration des cellules de cancer du sein, ainsi que pour supprimer l’angiogenèse, in vitro et in ovo (sur des embryons de poulet dans l’œuf).
Inhibition de l'angiogenèse
Des études in vitro utilisant les lignées cellulaires de cancer du sein MCF-7 et MDA-MB-231 ont montré que les AuNPs-GAL avaient une activité anticancéreuse plus élevée que la galangine seule ou les AuNPs seules.
Les AuNPs-GAL ont inhibé de manière significative l’expression des gènes ERK1 et VEGF dans les cellules MCF-7 et MDA-MB-231. Ces gènes jouent un rôle essentiel dans la prolifération, la migration et l’angiogenèse des cellules tumorales.
Le test de cicatrisation a montré que les AuNPs-GAL réduisaient significativement la migration des cellules MCF-7 et MDA-MB-231.
Des études in ovo utilisant le modèle de la membrane chorioallantoïque (CAM) de poulet ont montré que les AuNPs-GAL inhibaient significativement l’angiogenèse. Cela a été démontré par une réduction de la densité vasculaire et de la longueur des vaisseaux.
Les AuNPs agissent comme un système d’administration efficace, délivrant la galangine directement aux cellules tumorales, ce qui améliore sa biodisponibilité et son activité anticancéreuse. De plus, les AuNPs possèdent leurs propres propriétés anticancéreuses, ce qui contribue à l’effet global des AuNPs-GAL.
Ces résultats suggèrent que les AuNPs-GAL sont un agent anticancéreux et anti angiogénique prometteur pour le traitement du cancer du sein.
Cependant, des études in vivo supplémentaires sont nécessaires pour confirmer ces résultats et déterminer l’innocuité et l’efficacité des AuNPs-GAL chez les modèles animaux.
Quelle est la biodisponibilité de la galangine dans la propolis de peuplier ?
La biodisponibilité de la propolis brune suggère qu’elle est rapidement absorbée métabolisée et ne s’accumule pas dans l’organisme.
Administrée par voie orale à des souris, la galangine était rapidement absorbée et métabolisée en son dérivé glucuronidé. Cependant, ni la galangine ni ses métabolites n’ont été détectés dans le sang après une administration prolongée de propolis brune, et aucun métabolite n’a été trouvé dans le foie, ce qui indique qu’il n’y a pas d’accumulation à cet endroit.
Ces résultats suggèrent que la galangine et ses dérivés ont une courte biodisponibilité chez la souris.
Références scientifiques sur la galangine
Kaiwen Lin, Datian Fu, Zhongtao Wang, Xueer Zhang, and Canyang Zhu – Analgesic and anti-inflammatory effects of galangin: a potential pathway to inhibit transient receptor potential vanilloid 1 receptor activation – 2024
Malin SA, Molliver DC, Koerber HR, Cornuet P, Frye R, Albers KM, et al. Glial cell line-derived neurotrophic factor family members sensitize nociceptors in vitro and produce thermal hyperalgesia in vivo. J Neurosci 2006
Undem BJ, Taylor-Clark T. Mechanisms underlying the neuronal-based symptoms of allergy. J Allergy Clin Immunol 2014
Julius D. TRP channels and pain. Annu Rev Cell Dev Biol 2013
Manion J, Waller MA, Clark T, Massingham JN, Neely GG. Developing modern pain therapies. Front Neurosci 2019
Shen P, Huang Y, Ba X, Lin W, Qin K, Wang H, et al. Si Miao San attenuates inflammation and oxidative stress in rats with CIA via the modulation of the Nrf2/ARE/PTEN pathway. Evid Based Complement Alternat Med 2021
Che DN, Cho BO, Shin JY, Kang HJ, Kim JS, Oh H, et al. Apigenin inhibits IL-31 cytokine in human mast cell and mouse skin tissues. Molecules 2019
Lin K, Deng T, Qu H, Ou H, Huang Q, Gao B, et al. Gastric protective effect of Alpinia officinarum flavonoids: mediating TLR4/NF-κB and TRPV1 signalling pathways and gastric mucosal healing. Pharm Biol 2023
Cordenonsi LM, Sponchiado RM, Campanharo SC, Garcia CV, Raffin RP, Schapoval EES. Study of flavonoids present in pomelo (Citrus maxima) by DSC, UV-VIS, IR, 1H and 13C NMR and MS. Drug Anal Res 2017
Zhang R, Lu J, Pei G, Huang S. Galangin rescues Alzheimer’s amyloid-β induced mitophagy and brain organoid growth impairment. Int J Mol Sci 2023
Yang T, Liu H, Yang C, Mo H, Wang X, Song X, et al. Galangin attenuates myocardial ischemic reperfusion- induced ferroptosis by targeting Nrf2/Gpx4 signaling pathway. Drug Des Devel Ther 2023
Zhang F, Yan Y, Zhang LM, Li DX, Li L, Lian WW, et al. Pharmacological activities and therapeutic potential of galangin, a promising natural flavone, in age-related diseases. Phytomedicine 2023
Hassanein EHM, Abd El-Maksoud MS, Ibrahim IM, Abd-Alhameed EK, Althagafy HS, Mohamed NM, et al. The molecular mechanisms underlying anti-inflammatory effects of galangin in different diseases. Phytother Res 2023
Thapa R, Afzal O, Alfawaz Altamimi AS, Goyal A, Almalki WH, Alzarea SI, et al. Galangin as an inflammatory response modulator: an updated overview and therapeutic potential. Chem Biol Interact 2023
Chen K, Xue R, Geng Y, Zhang S. Galangin inhibited ferroptosis through activation of the PI3K/AKT pathway in vitro and in vivo. FASEB J 2022
Yang L, Ma XY, Mu KX, Dai Y, Xia YF, Wei ZF. Galangin targets HSP90β to alleviate ulcerative colitis by controlling fatty acid synthesis and subsequent NLRP3 inflammasome activation. Mol Nutr Food Res 2023
Chen QX, Zhou L, Long T, Qin DL, Wang YL, Ye Y, et al. Galangin exhibits neuroprotective effects in 6-OHDA-induced models of Parkinson’s disease via the Nrf2/Keap1 pathway. Pharmaceuticals (Basel) 2022
Lopes AJO, Vasconcelos CC, Garcia JBS, Dória Pinheiro MS, Pereira FAN, Camelo DS, et al. Anti-inflammatory and antioxidant activity of pollen extract collected by Scaptotrigona affinis postica: in silico, in vitro, and in vivo studies. Antioxidants (Basel) 2020
Malik H. Qaddoori and Hanady S. Al-Shmgani -Galangin-Loaded Gold Nanoparticles: Molecular Mechanisms of Antiangiogenesis Properties in Breast Cancer – 2023
- A. Al-Kubaisi, H. S. Al-Shmgani, and M. J. Salman, “Evaluation of in vivo and in vitro protective effects of quercetin on lipopolysaccharide-induced inflammation and cytotoxicology,” Research Journal of Pharmacy and Technology, vol. 13, 2020
- S. Anwar, H. S. Al-Shmgani, A. T. Tawfeeq, G. M. Sulaiman, and Y. H. Al-Mousawi, “In silico analysis of quercetin as potential anti-cancer agents,” Materials Today: Proceedings, vol. 42 2021.
- K. Patel, K. Patel, M. Gadewar, and V. Tahilyani, “Pharmacological and bioanalytical aspects of galangin-a concise report,” Asian Pacific Journal of Tropical Biomedicine, vol. 2, no. 1, pp. S449–S455, 2012.
- C. Jung, M. E. Kim, J. H. Yoon et al., “Anti-inflammatory effects of galangin on lipopolysaccharide-activated macrophages via ERK and NF-κB pathway regulation,” Immunopharmacology and Immunotoxicology, vol. 36, no. 6, pp. 426–432, 2014.
- Patil, V. Ujalambkar, A. Rathore, S. Rojatkar, and V. Pokharkar, “Galangin loaded galactosylated pluronic F68 polymeric micelles for liver targeting,” Biomedicine and Pharmacotherapy, 2019
- A. Bacanl, A. Başaran, and N. Başaran, “Chapter 34 – galangin as a plant phenolic and usage in health and disease,” in Polyphenols: Prevention and Treatment of Human Disease, R. R. Watson, V. R. Preedy, and S. Zibadi, Eds., pp. 2018.
- Dessale, G. Mengistu, and H. M. Mengist, “Nanotechnology: a promising approach for cancer diagnosis, therapeutics and theragnosis,” International Journal of Nanomedicine, vol. 17, pp. 3735–3749, 2022.
- Balakrishnan, F.A. Bhat, P. Raja Singh et al., “Gold nanoparticleconjugated quercetin inhibits epithelial-mesenchymal transition, angiogenesis and invasivenessviaEGFR/VEGFR-2-mediated pathway in breast cancer,” Cell Proliferation, vol. 49, no. 6, pp. 678–697, 2016
- Liskova, L. Koklesova, M. Samec et al., “Flavonoids in cancer metastasis,” Cancers, vol. 12, no. 6, p. 1498, 2020
Park, Y.K.; Paredes-Guzman, J.F.; Aguiar, C.L.; Alencar, S.M.; Fujiwara, F.Y. Chemical constituents in Baccharis dracunculifolia as the main botanical origin of southeastern Brazilian propolis. J. Agric. Food Chem. 2004
Kurek-Górecka, A.; Rzepecka-Stojko, A.; Górecki, M.; Stojko, J.; Sosada, M.; ´Swierczek-Zi˛eba, G. Structure and antioxidant activity of polyphenols derived from propolis. Molecules 2013
